
DTx, opportunità e limiti regolatori
Le terapie digitali sono tecnologie che realizzano interventi terapeutici veri e propri e sono guidate da programmi software di alta qualità, basati su evidenze scientifiche confermate attraverso sperimentazioni rigorose quanto quelle applicate nello sviluppo dei farmaci tradizionali. Le DTx si utilizzano per prevenire, gestire o trattare un ampio spettro di condizioni fisiche e mentali attraverso modifiche del comportamento e dello stile di vita dei pazienti.
In Italia le terapie digitali (DTx) sono ancora ‘orfane’ di una visione regolatoria
Le opportunità economiche di queste tecnologie sanitarie sono in crescita. Le stime del mercato aumentano anno su anno. Se nel 2021 si calcolava un fatturato di circa 3,8 miliardi di dollari, nel 2022 si è raggiunto un turnover globale pari a 4,5 miliardi di dollari destinato a sfiorare il 18 miliardi nel 2027 con una crescita composta annua (CAGR) del 31,6%. In realtà alcuni scenari sono persino più sostanziosi, ma spesso le stime sono gonfiate da definizioni del mercato che non includono strettamente le DTx ma alcuni settori della digital health. Inoltre, la mancanza di un contesto regolatorio europeo rende incerto lo scenario e più prudenti gli investimenti. Alcune evoluzioni più o meno recenti a livello comunitario come il GDPR sulla protezione dei dati, l’entrata in vigore del nuovo regolamento europeo sui dispositivi medici e le linee guida per la valutazione farmaco-economica, fanno sperare in una svolta utile a rendere omogenea la valutazione e l’accesso alle terapie digitali.
Il percorso tedesco per le DTx fa scuola
La Germania ha posto le basi per la definizione delle regolamentazioni nazionali finora esistenti già nel 2019.
Il Digital Healthcare Act (DVG) in quell’anno ha creato un percorso chiaro per proporre le terapie digitali (DiGA) per il rimborso che è stato definito "Fast Track". I criteri sono in linea con gli standard del nuovo regolamento europeo per i medical device MDR che richiedono una gestione della qualità secondo gli standard ISO 13485. Inoltre, dal 2022, il DVG richiede anche la gestione della sicurezza delle informazioni secondo ISO 27001.
Il sistema tedesco per i DiGA consente ai produttori di rilasciare le soluzioni rimborsabili che rispondono ai prerequisiti di qualità MDR e agli standard di protezione dei dati e interoperabilità per un periodo ‘di prova’ di dodici mesi, e utilizzarli per raccogliere ulteriori prove scientifiche in merito alla sicurezza e all'efficacia in real world.
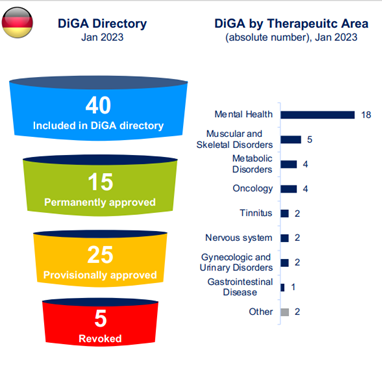
Dopo il periodo di approvazione provvisoria, se i prerequisiti di sicurezza ed efficacia sono confermati, i DiGA entrerebbero permanentemente nell’elenco dei prodotti prescrivibili e rimborsabili. A inizio 2023 l’elenco contava 40 DTx (15 permanenti e 25 provvisori). L’area terapeutica più rappresentata è quella della salute mentale¹.
Il percorso tedesco sarà adattato in Francia
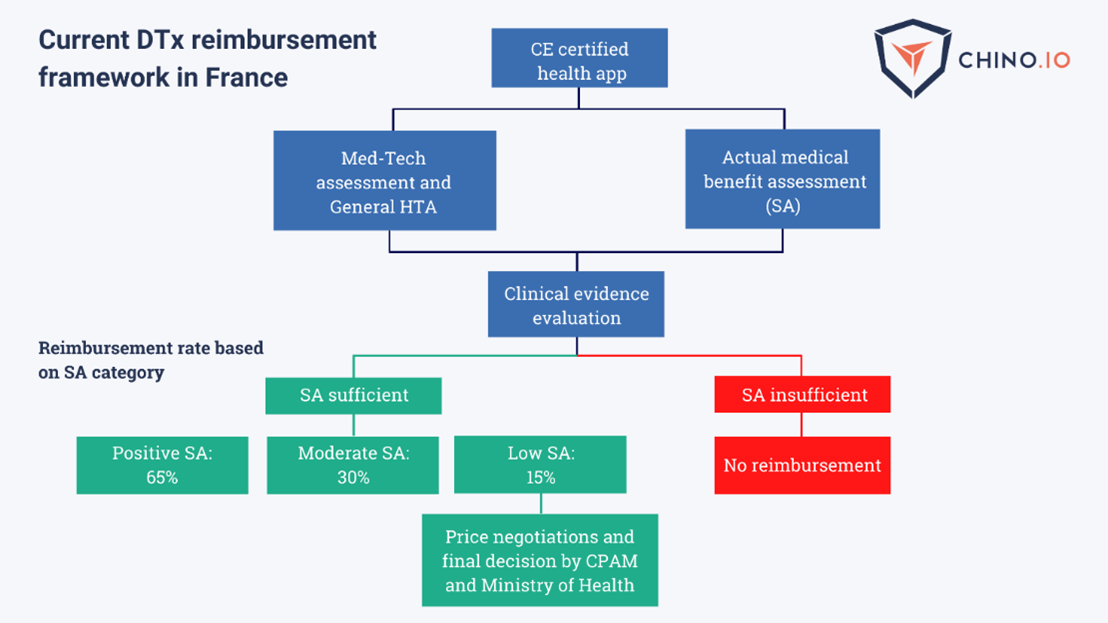
Il presidente Macron già nel 2021 annunciava una corsia preferenziale per rendere le terapie digitali accessibili e rimborsabili dal servizio pubblico, e il Ministero della Salute francese sta lavorando per raggiungere questo obiettivo entro la fine di quest’anno.
Anche in Francia le terapie digitali dovranno ottenere la Marcatura CE come dispositivo medico, la conformità privacy-GDPR, e inoltre seguire un percorso rigoroso di valutazione tecnica-clinica e di valore aggiunto socioeconomico.
Il Belgio ed il sistema di convalida della mobile health
Il Belgio sta seguendo un percorso simile e la prima soluzione DTx è stata accettata temporaneamente per il rimborso in attesa della finalizzazione dello studio clinico.
L’Ente Nazionale per la Salute (NIHDI) sta definendo il contesto definitivo per portare le DTx a rimborso. Queste soluzioni per ottenere l’approvazione devono raggiungere il livello più alto (M3) del sistema di convalida della mobile health e superare la valutazione da parte dell’Agenzia Federale per i Medicinali (l’equivalente di AIFA):
- Livello M1 - Valutazione della marcatura CE come dispositivo medico e conformità privacy-GDPR.
- Livello M2 - Valutazione della valutazione del rischio per la sicurezza dei dati, il segreto medico, la connettività e la valutazione dell'interoperabilità per garantire uno scambio sicuro di dati tra tutte le parti interessate del settore sanitario.
- Livello M3 - Dimostrazione di evidenze cliniche e valore aggiunto socioeconomico.
Ci sono ad oggi 34 applicazioni M1 e M2 ma soltanto per una è stato concesso temporaneamente (in M3) il rimborso basato sulla conferma delle evidenze cliniche.
Il Regno Unito e il DTAC (Digital Technology Assessment Criteria)
Nel Regno Unito dopo una prima esperienza iniziata nel 2017 con l’istituzione di una Apps Library che raccoglieva informazioni su tutte le soluzioni di digital health, questa è stata dismessa a favore di un sistema chiamato DTAC (Digital Technology Assessment Criteria) che garantisce che le app siano conformi ai criteri stabiliti di sicurezza clinica, protezione dei dati, sicurezza, interoperabilità e accesso.
Alle DTx si richiede il marchio CE o il locale UKCA, l’ottemperanza al GDPR e il superamento dei DTAC stabiliti dal NICE. Proprio questo ente nel febbraio del 2023 ha deciso di definire un percorso accelerato – EVA – (Early Value Assessment) per alcune terapie digitali basate sui principi dell’approccio cognitivo comportamentale per trattare bambini e ragazzi con sintomi lievi e moderati di ansia².
Si tratta di una importante eccezione ai severissimi criteri del NICE. L’ente ha valutato i primi dati su queste tecnologie per determinare se sia appropriato un accesso anticipato al Servizio Sanitario Nazionale da parte dei pazienti e dei sistemi mentre vengono generate ulteriori evidenze. I risultati non suggeriscono un rischio per la sicurezza dei pazienti.
Nei prossimi anni verranno prodotte ulteriori prove per valutare se i benefici di queste tecnologie si realizzeranno nella pratica. La guida NICE sarà rivista periodicamente per formulare ulteriori raccomandazioni.
L’iniziativa nasce dalla constatazione che il percorso sulle tecnologie digitali inizialmente sperimentato nel 2019, ha visto una sola raccomandazione positiva da parte del NICE da quando è entrato in funzione (la app Sleepio³ per l’insonnia).
L’Italia, un faro senza luce
L’Italia sviluppa ma non definisce un percorso regolatorio per il SSN.
In Italia sono attualmente in sperimentazione clinica diverse terapie digitali. Naturalmente, come negli altri esempi finora citati, esse devono aver ottenuto la certificazione come dispositivo medico secondo la più recente normativa e rispondere agli standard di protezione dei dati e qualità. Malgrado le diverse iniziative in corso per dimostrarne anche i vantaggi clinici e socioeconomici con i rigorosi percorsi dei trial clinici randomizzati non sembra ancora sussistere a livello politico e scientifico la consapevolezza del loro potenziale malgrado le evidenze diffuse e pubblicate su molte riviste scientifiche.
Il dibattito in merito all’urgenza di definire un percorso che porti dall’accesso (atteso relativamente a breve visto lo sviluppo avanzato e positivo di alcuni trial) a chiare regole di rimborsabilità è molto partecipato e ha prodotto diversi risultati incoraggianti specie nell’ambito delle malattie mentali⁴.
Al momento, tuttavia, non sembra esserci la volontà di utilizzare, per esempio, le risorse della Missione 6⁵ nel PNNR per procedere ad accelerare i necessari sviluppi tecnici e le altrettanto indispensabili riflessioni organizzative e di formazione per tutti gli stakeholder coinvolti.
RIFERIMENTI
- 1 A. Spreafico & V. Boccardo, Digital Health & Innovation Strategy, Healthware

Cliccando sul seguente link abbandonerà questo sito e accedendo al sito appena selezionato lei sarà soggetto alle condizioni di utilizzo di questo ultimo.
Polifarma non si assume alcuna responsabilità relativamente ai contenuti presenti.
A. Spreafico & V. Boccardo, Digital Health & Innovation Strategy, Healthware - 2 Overview | Guided self-help digital cognitive behavioural therapy for children and young people with mild to moderate symptoms of anxiety or low mood: early value assessment | Guidance | NICE

Cliccando sul seguente link abbandonerà questo sito e accedendo al sito appena selezionato lei sarà soggetto alle condizioni di utilizzo di questo ultimo.
Polifarma non si assume alcuna responsabilità relativamente ai contenuti presenti.
Overview | Guided self-help digital cognitive behavioural therapy for children and young people with mild to moderate symptoms of anxiety or low mood: early value assessment | Guidance | NICE - 3 Sleepio

Cliccando sul seguente link abbandonerà questo sito e accedendo al sito appena selezionato lei sarà soggetto alle condizioni di utilizzo di questo ultimo.
Polifarma non si assume alcuna responsabilità relativamente ai contenuti presenti.
Sleepio - 4 Spreafico A., Starace F. et al. Le terapie Digitali a potenziamento dei percorsi di cura per la depressione nel Servizio Sanitario Nazionale: Proposte per L’Italia. Marzo 2023

Cliccando sul seguente link abbandonerà questo sito e accedendo al sito appena selezionato lei sarà soggetto alle condizioni di utilizzo di questo ultimo.
Polifarma non si assume alcuna responsabilità relativamente ai contenuti presenti.
Spreafico A., Starace F. et al. Le terapie Digitali a potenziamento dei percorsi di cura per la depressione nel Servizio Sanitario Nazionale: Proposte per L’Italia. Marzo 2023 - 5 La Missione 6 salute (M6)

Cliccando sul seguente link abbandonerà questo sito e accedendo al sito appena selezionato lei sarà soggetto alle condizioni di utilizzo di questo ultimo.
Polifarma non si assume alcuna responsabilità relativamente ai contenuti presenti.
La Missione 6 salute (M6)
